Camara de neubauer pdf
Función del hemocitómetro
Acceda gratuitamente a la guía PDF más completa sobre métodos de recuento de células (35 páginas) elaborada por nuestros especialistas, la Dra. Katja Schulze, especializada en bioinformática y reconocimiento de imágenes microscópicas, y el Dr. Ulrich M. Tillich, especializado en automatización de laboratorios.
Si trabaja con levaduras, ya sea como cervecero, vinicultor, panadero, productor de etanol o, básicamente, cualquier otra profesión que implique la manipulación de levaduras, lo más probable es que tenga que realizar recuentos de células de levadura y evaluaciones de su viabilidad. Es decir, si quiere tener un control total sobre el proceso de fermentación o si está cosechando, recolectando y tal vez propagando la levadura y cultivando su propio banco de levadura.
Y si todavía no ha automatizado sus recuentos de células, probablemente esté determinando la concentración de células de levadura y la viabilidad utilizando un hemocitómetro y un microscopio. Es el método manual más simple y sencillo para contar las células. Sin embargo, como hemos descubierto una y otra vez, también es un método propenso a errores, lo que se ve agravado por el hecho de que existen varios tipos de cámaras de recuento, cada una con sus especificidades. Las más utilizadas, sin embargo, son la Cámara Neubauer (Thoma) y la Cámara Neubauer Mejorada.
Cómo cargar la cámara de neubauer
Aunque se han desarrollado diversos instrumentos automatizados para el recuento de células, el hemocitómetro sigue siendo el método más utilizado para el recuento de células en todo el mundo. El hemocitómetro más utilizado es la cámara de Neubauer (o "Neubauer mejorada").
Otros hemocitómetros son el Burker, el Thoma y el Fuchs-Rosenthal. Con ellos, las partículas (por ejemplo, leucocitos, eritrocitos, trombocitos, bacterias, esporas de hongos, polen) se cuentan visualmente al microscopio.
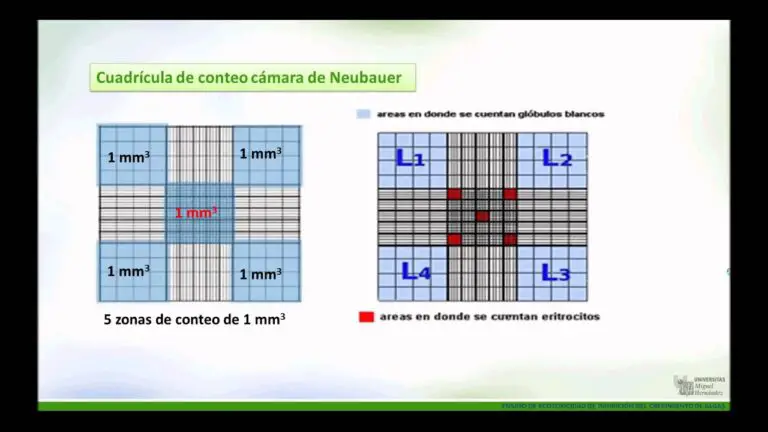
La cámara de Neubauer es una placa de vidrio gruesa con el tamaño de un portaobjetos de vidrio (30x70x4mm). La región de recuento consta de dos áreas regladas de forma cuadrada. Hay depresiones o fosos a ambos lados o entre las zonas en las que se marcan los cuadrados, lo que da una forma de "H".
La zona reglada es de 3 mm2 y está dividida en 9 grandes cuadrados de 1 mm2 cada uno. El gran cuadrado central (que puede verse en su totalidad con el objetivo de 10X), está dividido en 25 cuadrados medianos con líneas dobles o triples.
La tapa de cristal es un cristal cuadriculado de 22 mm de ancho. La tapa de cristal se coloca en la parte superior de la cámara de Neubauer, cubriendo la zona central. La zona reglada es 0,1 mm más baja que el resto de la cámara.
Portaobjetos del hemocitómetro
El recuento de células (eucariotas y especialmente de mamíferos) en un hemocitómetro es un método antiguo pero todavía valioso para cuantificar el número de células por mL en una suspensión. En los siguientes párrafos, hemos esbozado los puntos más importantes para el recuento con un hemocitómetro. También queremos dar pistas de por dónde empezar a solucionar problemas cuando surjan problemas con los recuentos.
En general, se pueden utilizar muchos tipos diferentes de cámaras para contar células. Sin embargo, la cámara de Neubauer mejorada y la cámara de Thoma son las más utilizadas en el cultivo celular. Aquí se ofrece un buen resumen de las subdivisiones de los cuadrados de recuento en diferentes tipos de cámaras (con etiquetas en alemán) Optik Labor.
El azul Trypan es una tinción vital. Esto significa que las células intactas no absorben el colorante y no se tiñen, mientras que las células muertas o dañadas absorben el colorante y aparecen de color azul a lila en el microscopio. La tinción se realiza mezclando una solución de azul tripán con la suspensión celular que se va a contar en un tubo de microrreacción (por ejemplo, de 1:2 a 1:10, según la densidad de la suspensión celular). Tras la mezcla, la solución se cuenta como es habitual en el hemocitómetro. Se cuentan las células no teñidas = células vitales y sanas y las azules = células muertas y dañadas. A continuación se calcula el porcentaje de células vitales = células vitales / (vitales+muertas). Dependiendo del tipo de célula, se documenta un rango normal de vitalidad (por ejemplo, 90-95% para muchas líneas celulares, 60-70% para muchas líneas de células T, 50-69% para hepatocitos primarios, etc.). Es importante señalar que el azul tripán en sí mismo es ligeramente citotóxico. Después de 5-10 minutos empieza a matar las células. Por lo tanto, las muestras no deben ser "almacenadas" durante más de 5 minutos antes del recuento.
